El enemigo ya está identificado, mide 120 nm y tiene 30.000 pares de bases, y tiene como característica especial esas espículas ( espigas) que están formadas por 1274 aminoácidos.
La fotografia de arriba es la union de la spike protein del SARS-CoV2 con el receptor de la ACE humana/2 ( Angiotensin Converting Enzym 2).
Nos vamos a encontrar dichos receptores en diversos órganos: pulmon ( por eso produce la COVID neumonias bilaterales), corazón ( por eso produce miocarditis), riñon ( por eso produce fallos renales), , tubo digestivo (por eso produce o puede producir diarreas), y receptores sofisticados en las venas y arterias (por eso puede producir embolismos, coagulopatías).
La proteína S, con sus 1274 aminoácidos y esa "cazoleta" de uniñon de unos 50x 60 Astrong , formando esa "sagrada avidad " centrada en el eje del trímero que tiene ~65 Å de profundidad. Samems que los aminoacidos 980-990 quedarían "dentro" de la zona de heptámeros repetidos 1 (HR1) en la parte superior de S2.
Esto es más complicado porque la tñecnica que se utiliza para detrminar estas estructuras con una resolucin de 3 Amstrong no permiten ver bien esa región HR1 por sus estructura helicoidal, pero si que creemos que donde se establece esa unión con el receptor ACE/2 de la especie humana podría ser el nudo gordiano resolutivo para diseñar un fármaco capaz de interferir en el proceso de fijacion o anclaje del virus a los receptores de las células epiteliales del pulmon. Podría ser la solución si alguna de las vacunas basadas en m RNA para generar anticuerpos contra esos 1274 aminoácidos que forman esa spike proteín. Podria...podria...podría...demasiados tiempos condicionales.
El enemigo ya está identificado, mide 120 nm y tiene 30.000 pares de bases, y tiene como característica especial esas esoículas que están formadas por 1274 aminoácidos.
Sabenos que en realidad esa S proteín o proteina espicular es la " marca" mas relevante del virus. Sabemos que es un trímero, que está en una posición "up" y dos posiciones "down".
Aquí tenemos a la proteína S en acción. Dentro video:
Se utilizan los modelos "in silicio" para estudiar el diseño de nuevos fármacos. Igualmente la VR nos permite visualizar los mecanismos de accion de algunos de ellos. Por ejemplo el Remdesavir cuando inhibe la polimerasa del SARS-CoV-2.
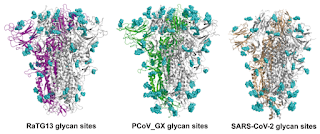
Sería un proceso complicado que ocurre en el 2 % de los complejos estudiados), la unión de una espícula a tres receptores ACE2 en la membrana celular.O , mejor expresado, a que el virus pudiera tener una " mayor posibilidad" de unirse ya que puede unirse a tres receptores diferentes al ser trímerico. Volveremos luego a ello cuando veamos las afinidades de las diferentes "espígas" de diferentes especies ( en la figura de abajo, la de murciélago de herradura, la de pangolín y las del SARS-CoV-2).
"La comparación entre el trímero abierto y el complejo con una ACE2 unida al trímero muestra que la unión rota el RBD de la S1 abierta alejando su centro de masas ~5.5 Å respecto al eje del trímero y al mismo tiempo aleja los tres NTD de las S2 del trímero ~1.5–3.0 Å; la unión a una o dos ACE2 adicionales no introduce cambios significativos en la conformación de la primera unión. Estos cambios de conformación estabilizan la unión de ACE2 en el complejo". / Fuente " La Ciencia de la Mula Francis".
Los resultados apuntan a que la probabilidad de fusión entre
membranas está favorecida por el número de receptores ACE2 unidos a la
proteína espicular. Así la infección sería más probable en células que
expresen un gran número de receptores ACE2 ( mas en hombres que en mujeres, ausencia en niños d emenos de 8 años, donde no hayreceptores ACE/2. Deberemos
ser cautos porque éste supuesto aumento de infecciosidad no está
demostrado que realmente se manifieste de forma clínica. Como dicen David baltimore y Vincet Racaniello, " el desarrollo de la infeccion no
implica necesariamente la manifestacion de la enfermedad".













No hay comentarios:
Publicar un comentario